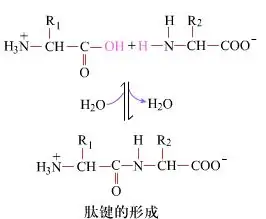
In superficie, la formazione di legami peptidici, producendo dipeptidi, è un semplice processo chimico. Ciò significa che i due componenti di aminoacidi sono collegati da un legame peptidico, un legame ammidico, pur essendo disidratato.
La formazione del legame peptidico è l'attivazione di un aminoacido in condizioni di reazione lievi. (A) Prazione carbossilica, secondo aminoacido (B) La porzione carbossilica attivata nucleofila forma quindi il dipeptide (A-B). "Se il componente carbossilico (A) non è protetto, la formazione del legame peptidico non può essere controllata." I sottoprodotti come peptidi lineari e ciclici possono essere miscelati con composti bersaglio A-B. Pertanto, tutti i gruppi funzionali non coinvolti nella formazione del legame peptidico devono essere protetti in modo temporaneamente reversibile durante la sintesi peptidica.
Quindi, la sintesi peptidica - la formazione di ciascun legame peptidico - comporta tre fasi di aggregazione.
Il primo passo è preparare alcuni aminoacidi che necessitano di protezione e la struttura zwitterionica degli aminoacidi non esiste più.
Il secondo passo è una reazione in due fasi per formare legami peptidici, in cui il gruppo carbossilico dell'amminoacido protetto da N viene prima attivato nell'intermedio attivo e quindi si forma il legame peptidico. Questa reazione accoppiata può verificarsi come reazione a un passo o come due reazioni sequenziali.
Il terzo passo è la rimozione selettiva o la completa rimozione della base protettiva. Sebbene tutta la rimozione possa verificarsi solo dopo che tutte le catene di peptidi sono state assemblate, è necessaria anche la rimozione selettiva di gruppi protettivi per continuare la sintesi dei peptidi.
Perché 10 aminoacidi (Ser, Thr, Tyr, ASP, Glu, Lys, Arg, His, Sec e Cys) contengono gruppi funzionali a catena laterale, che richiedono protezione selettiva, rendendo più complicata la sintesi peptidica. Le basi di protezione temporanea e semi-permanente devono essere distinte a causa dei diversi requisiti per la selettività. I gruppi di protezione temporanei vengono utilizzati nella fase successiva per riflettere la protezione temporanea dei gruppi funzionali aminoacidi o carbossilici. I gruppi protettivi semi-permanenti vengono rimossi senza interferire con legami peptidici già formati o catene laterali di aminoacidi, a volte durante la sintesi.
"Idealmente, l'attivazione del componente carbossilico e la successiva formazione di legami peptidici (reazioni di accoppiamento) dovrebbero essere rapide, senza formazione racemica o sottoprodotto, e i reagenti molari dovrebbero essere applicati per ottenere rese elevate." Sfortunatamente, nessuno dei metodi di accoppiamento chimico soddisfa questi requisiti e pochi sono adatti alla sintesi pratica.
Durante la sintesi peptidica, i gruppi funzionali coinvolti in varie reazioni sono generalmente collegati al centro manuale, la glicina è l'unica eccezione e c'è un potenziale rischio di rotazione.
Il passaggio finale nel ciclo di sintesi peptidica è la rimozione di tutti i gruppi protettivi. La rimozione selettiva dei gruppi protettivi è importante per l'estensione della catena dei peptidi oltre al requisito per la completa rimozione della protezione nella sintesi di dipeptidi. Le strategie sintetiche dovrebbero essere pianificate attentamente. A seconda della scelta strategica, N può rimuovere selettivamente i gruppi di protezione α-ammino o carbossil. Il termine "strategia" si riferisce alla sequenza delle reazioni di condensa dei singoli aminoacidi. In generale, c'è una differenza tra sintesi graduale e condensazione dei frammenti. La sintesi peptidica (nota anche come "sintesi convenzionale") si svolge in soluzione. Nella maggior parte dei casi, l'allungamento graduale della catena dei peptidi può essere sintetizzato solo usando la catena peptidica per sintetizzare frammenti più corti. Per sintetizzare i peptidi più lunghi, le molecole target devono essere segmentate in frammenti appropriati e determinare che possono ridurre al minimo il grado di differenziazione al terminale C. Dopo che i singoli frammenti sono stati assemblati gradualmente, il composto target verrà unito. La strategia di sintesi peptidica include la selezione del frammento protettivo migliore e più appropriato e la strategia di sintesi peptidica include la selezione della combinazione più appropriata di basi protettive e il miglior metodo di coniugazione dei frammenti.
Tempo post: 2025-07-02