I peptidi sono una classe di composti formati dalla connessione di più aminoacidi attraverso legami peptidici. Sono onnipresenti negli organismi viventi. Fino ad ora, decine di migliaia di peptidi sono stati trovati negli organismi viventi. I peptidi svolgono un ruolo importante nella regolazione delle attività funzionali di vari sistemi, organi, tessuti e cellule e nelle attività della vita e sono spesso utilizzati nell'analisi funzionale, nella ricerca degli anticorpi, nello sviluppo dei farmaci e in altri campi. Con lo sviluppo della biotecnologia e della tecnologia di sintesi peptidica, sempre più farmaci peptidici sono stati sviluppati e applicati in clinica.
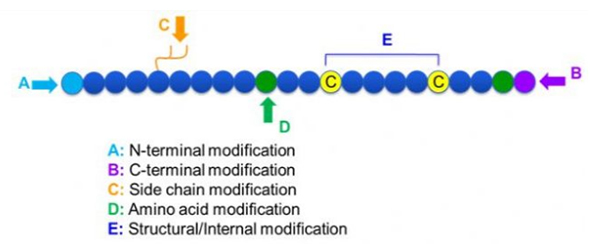
Esistono un'ampia varietà di modifiche peptidiche, che possono essere semplicemente divise in modifica post-modifica e modifica del processo (usando la modifica dell'aminoacido derivata) e modifica N-terminale, modifica del terminale C, modifica della catena laterale, modifica degli aminoacidi, modifica dello scheletro, ecc., A seconda del sito di modifica (Figura 1). Come mezzo importante per cambiare la struttura della catena principale o i gruppi della catena laterale di catene peptidiche, la modifica dei peptidi può cambiare efficacemente le proprietà fisiche e chimiche dei composti peptidici, aumentare la solubilità dell'acqua, prolungare il tempo di azione in vivo, cambiare la loro distribuzione biologica, eliminare l'immunogenicità, ridurre gli effetti collaterali tossici, ecc. In questo documento, diverse strategie di modifica del peptide e sono introdotte.
1. Cyclization
I peptidi ciclici hanno molte applicazioni nella biomedicina e molti peptidi naturali con attività biologica sono peptidi ciclici. Poiché i peptidi ciclici tendono ad essere più rigidi dei peptidi lineari, sono estremamente resistenti al sistema digestivo, possono sopravvivere nel tratto digestivo e mostrare una più forte affinità per i recettori bersaglio. La ciclizzazione è il modo più diretto per sintetizzare i peptidi ciclici, in particolare per i peptidi con scheletro strutturale di grandi dimensioni. Secondo la modalità di ciclizzazione, può essere diviso nel tipo di catena lato catena laterale, tipo di catena laterale - tipo di terminale - tipo di terminale (tipo di estremità a estremità).
(1) sidechain-to-sidechain
Il tipo più comune di ciclizzazione della catena laterale a catena laterale è il disolfuro che si collega tra i residui di cisteina. Questa ciclizzazione è introdotta da una coppia di residui di cisteina che vengono deprotetti e quindi ossidati per formare legami disolfuro. La sintesi policiclica può essere ottenuta mediante rimozione selettiva dei gruppi di protezione da solfidril. La ciclizzazione può essere eseguita in un solvente post-disociazione o su una resina pre-disociazione. La ciclizzazione sulle resine può essere meno efficace della ciclizzazione del solvente perché i peptidi sulle resine non formano prontamente le conformazioni ciclificate. Un altro tipo di ciclizzazione a catena laterale - laterale è la formazione di una struttura ammidica tra un acido aspartico o residuo di acido glutammico e l'amminoacido di base, che richiede che il gruppo di protezione della catena laterale debba essere rimosso selettivamente dal polipeptide sulla resina o dopo la dissociazione. Il terzo tipo di ciclizzazione a catena laterale-la latera è la formazione di difenil eteri mediante tirosina o p-idrossifenilglicina. Questo tipo di ciclizzazione nei prodotti naturali si trova solo nei prodotti microbici e i prodotti di ciclizzazione hanno spesso un potenziale valore medicinale. La preparazione di questi composti richiede condizioni di reazione uniche, quindi non sono spesso utilizzati nella sintesi di peptidi convenzionali.

(2) Terminal-to-Sidechain
La ciclizzazione della catena lato terminale di solito coinvolge il terminale C con il gruppo amminico della catena laterale di lisina o ornitina o il N-terminale con l'acido aspartico o la catena laterale dell'acido glutammico. Altra ciclizzazione polipeptidica viene realizzata formando legami etere tra le catene laterali C terminale e serina o treonina.
(3) Terminale o tipo testa a coda
I polipeptidi a catena possono essere pedalati in un solvente o fissati su una cylation a catena di resina by. Basse concentrazioni di peptidi dovrebbero essere utilizzate nella centralizzazione dei solventi per evitare l'oligomerizzazione dei peptidi. La resa di un polipeptide ad anello sintetico testa a coda dipende dalla sequenza del polipeptide a catena. Pertanto, prima di preparare i peptidi ciclici su larga scala, è necessario creare una libreria di possibili peptidi di piombo incatenati, seguita dalla ciclizzazione per trovare la sequenza con i migliori risultati.
2. N-metilazione
La metilazione N si verifica originariamente nei peptidi naturali e viene introdotta nella sintesi dei peptidi per prevenire la formazione di legami idrogeno, rendendo così i peptidi più resistenti alla biodegradazione e alla clearance. La sintesi di peptidi usando derivati di aminoacidi N-metilati è il metodo più importante. Inoltre, è possibile utilizzare anche la reazione Mitsunobu di N- (cloruro di solfonilfonil cloruro di 2-nitrobenzene)-resina con metanolo. Questo metodo è stato utilizzato per preparare librerie cicliche di peptidi contenenti aminoacidi N-metilati.
3. Fosforilazione
La fosforilazione è una delle modifiche post-traduzionali più comuni in natura. Nelle cellule umane, oltre il 30% delle proteine sono fosforilati. La fosforilazione, in particolare la fosforilazione reversibile, svolge un ruolo importante nel controllo di molti processi cellulari, come la trasduzione del segnale, l'espressione genica, il ciclo cellulare e la regolazione del citoscheletro e l'apoptosi.
La fosforilazione può essere osservata su una varietà di residui di aminoacidi, ma gli obiettivi di fosforilazione più comuni sono i residui di serina, treonina e tirosina. I derivati della fosfotirosina, della fosforeonina e della fosfoserina possono essere introdotti nei peptidi durante la sintesi o formati dopo la sintesi peptidica. La fosforilazione selettiva può essere ottenuta utilizzando residui di serina, treonina e tirosina che rimuovono selettivamente i gruppi di protezione. Alcuni reagenti di fosforilazione possono anche introdurre gruppi di acido fosforico nel polipeptide mediante modifica post. Negli ultimi anni, la fosforilazione specifica del sito della lisina è stata raggiunta utilizzando una reazione di staudinger-fosfita chimicamente selettiva (Figura 3).

4. Myristoylation e palmitoilazione
L'acilazione del terminale N con acidi grassi consente a peptidi o proteine di legarsi alle membrane cellulari. La sequenza miridamoilata sul terminale N consente di colpire le proteine della famiglia SRC e le proteine GAQ della trascrittasi inversa di essere mirate a legarsi alle membrane cellulari. L'acido miristico era collegato al terminale N del polypeptide di resina usando reazioni di accoppiamento standard e il lipopeptide risultante poteva essere dissociato in condizioni standard e purificato da RP-HPLC.
5. Glicosilazione
Glicopeptidi come la vancomicina e la teicolanina sono importanti antibiotici per il trattamento delle infezioni batteriche resistenti ai farmaci e altri glicopeptidi sono spesso usati per stimolare il sistema immunitario. Inoltre, poiché molti antigeni microbici sono glicosilati, è di grande significato studiare i glicopeptidi per migliorare l'effetto terapeutico dell'infezione. D'altra parte, è stato scoperto che le proteine sulla membrana cellulare delle cellule tumorali mostrano glicosilazione anormale, che fa sì che i glicopeptidi svolgano un ruolo importante nella ricerca sul cancro e sulla difesa immunitaria del tumore. I glicopeptidi sono preparati con il metodo FMOC/T-BU. I residui glicosilati, come la treonina e la serina, vengono spesso introdotti nei polipeptidi mediante FMOCS attivati da estere pentafluorofenolo per proteggere gli aminoacidi glicosilati.
6. Isoprene
L'isopentadienilazione si verifica sui residui di cisteina nella catena laterale vicino al terminale C. L'isoprene della proteina può migliorare l'affinità della membrana cellulare e formare l'interazione proteina-proteina. Le proteine isopentadienate comprendono la tirosina fosfatasi, la piccola GTASE, le molecole di cochaperone, la lamina nucleare e le proteine leganti centromeriche. I polipeptidi isoprene possono essere preparati usando isoprene su resine o introducendo derivati della cisteina.
7. Modifica in polietilenglicole (PEG)
La modifica PEG può essere utilizzata per migliorare la stabilità idrolitica proteica, la biodistribuzione e la solubilità del peptide. L'introduzione delle catene PEG ai peptidi può migliorare le loro proprietà farmacologiche e inibire anche l'idrolisi dei peptidi da parte degli enzimi proteolitici. I peptidi PEG attraversano la sezione trasversale capillare glomerulare più facilmente rispetto ai normali peptidi, riducendo notevolmente la clearance renale. A causa dell'emivita attiva estesa dei peptidi PEG in vivo, il normale livello di trattamento può essere mantenuto con dosi più basse e farmaci peptidici meno frequenti. Tuttavia, la modifica PEG ha anche effetti negativi. Grandi quantità di PEG impediscono all'enzima di degradare il peptide e ridurre anche il legame del peptide al recettore target. Ma la bassa affinità dei peptidi PEG è generalmente compensata dalla loro emivita farmacocinetica più lunga e, essendo presenti nel corpo più a lungo, i peptidi PEG hanno una maggiore probabilità di essere assorbiti nei tessuti bersaglio. Pertanto, le specifiche del polimero PEG dovrebbero essere ottimizzate per risultati ottimali. D'altra parte, i peptidi PEG si accumulano nel fegato a causa della ridotta clearance renale, con conseguente sindrome macromolecolare. Pertanto, le modifiche PEG devono essere progettate più attentamente quando i peptidi vengono utilizzati per i test antidroga.

I gruppi di modifica comuni di modificatori PEG possono essere approssimativamente riassunti come segue: amino (-amina) -NH2, aminometil -ch2 -nh2, idrossi -oh, carbossia -cooh, solfidryl (-thiol) -sh, maleimide -mal, gatto di succinimide -SC, succinimide -scm, propionato -sspate, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinimide, succinile n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hydrazide, alkyne-alkyne, p -toluenesolfonate -ots, succinimide succinato -ss, ecc. I derivati PEG con acidi carbossilici possono essere accoppiati a ammine N -terminale o catene laterali di lisina. PEG amino-attivato può essere accoppiato all'acido aspartico o alle catene laterali dell'acido glutammico. Il PEG attivato da Mal può essere coniugato al mercaptan di catene laterali di cisteina completamente deprotetta [11]. I modificatori PEG sono comunemente classificati come segue (NOTA: MPEG è Metossi-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Modificatore PEG a catena dritta
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) Modificatore PEG bifunzionale
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCl · NH2-PEG-COOH, MAL-PEG-NHS
(3) Modificatore PEG di ramificazione
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-Mal
8. Biotinizzazione
La biotina può essere fortemente legata con avidina o streptavidina e la forza di legame è persino vicina al legame covalente. I peptidi marcati con biotina sono comunemente usati nel test immunologico, nell'istocitochimica e nella citometria a flusso basata sulla fluorescenza. Gli anticorpi di antibiotina etichettati possono anche essere usati per legare i peptidi biotinilati. Le etichette di biotina sono spesso attaccate alla catena laterale della lisina o al terminale N. L'acido 6-aminocaproico è spesso usato come legame tra peptidi e biotina. Il legame è flessibile in legame al substrato e si lega meglio in presenza di ostacoli sterici.
9. Etichettatura fluorescente
L'etichettatura fluorescente può essere utilizzata per tracciare i polipeptidi nelle cellule viventi e per studiare enzimi e meccanismi d'azione. Il triptofano (TRP) è fluorescente, quindi può essere utilizzato per l'etichettatura intrinseca. Lo spettro di emissione del triptofano dipende dall'ambiente periferico e diminuisce con la decisione di polarità del solvente, una proprietà che è utile per rilevare la struttura peptidica e il legame del recettore. La fluorescenza del triptofano può essere spenta dall'acido aspartico protonato e dall'acido glutammico, che può limitarne l'uso. Il gruppo di cloruro di Dansil (Dansil) è altamente fluorescente se legato a un gruppo amminico ed è spesso usato come etichetta fluorescente per aminoacidi o proteine.
La conversione dell'energia di risonanza di fluorescenza (FRET) è utile per gli studi enzimatici. Quando viene applicato FRET, il polipeptide del substrato di solito contiene un gruppo di etichettatura della fluorescenza e un gruppo di rimozione della fluorescenza. I gruppi fluorescenti etichettati vengono estinti dallo quencher attraverso il trasferimento di energia non fotoni. Quando il peptide viene dissociato dall'enzima in questione, il gruppo di etichettatura emette fluorescenza.
10. Polipeptidi della gabbia
I peptidi in gabbia hanno gruppi protettivi otticamente rimovibili che proteggono il peptide dal legame al recettore. Se esposto alle radiazioni UV, il peptide viene attivato, ripristinando la sua affinità con il recettore. Poiché questa attivazione ottica può essere controllata in base al tempo, all'ampiezza o alla posizione, i peptidi in gabbia possono essere usati per studiare le reazioni che si verificano nelle cellule. I gruppi protettivi più comunemente usati per i polipeptidi in gabbia sono i gruppi 2-nitrobenzilici e i loro derivati, che possono essere introdotti nella sintesi peptidica attraverso derivati protettivi di aminoacidi. I derivati degli aminoacidi sviluppati sono lisina, cisteina, serina e tirosina. I derivati asparti e glutammato, tuttavia, non sono comunemente usati a causa della loro suscettibilità alla ciclizzazione durante la sintesi e la dissociazione dei peptidi.
11. Peptide poliantigenico (mappa)
I peptidi corti di solito non sono immuni e devono essere accoppiati alle proteine portanti per produrre anticorpi. Il peptide poliantigenico (MAP) è composto da più peptidi identici collegati ai nuclei di lisina, che possono esprimere specificamente immunogeni ad alta potenza e può essere utilizzato per preparare dischi proteici del carratore peptidico. I polipeptidi della mappa possono essere sintetizzati mediante sintesi di fase solida sulla resina della mappa. Tuttavia, l'accoppiamento incompleto si traduce in catene peptidiche mancanti o troncate su alcuni rami e quindi non mostra le proprietà del polipeptide della mappa originale. In alternativa, i peptidi possono essere preparati e purificati separatamente e quindi accoppiati alla mappa. La sequenza peptidica attaccata al nucleo peptidico è ben definita e facilmente caratterizzata dalla spettrometria di massa.
Conclusione
La modifica dei peptidi è un mezzo importante per progettare peptidi. I peptidi modificati chimicamente possono non solo mantenere un'elevata attività biologica, ma anche evitare efficacemente gli svantaggi dell'immunogenicità e della tossicità. Allo stesso tempo, la modifica chimica può dotare peptidi di alcune nuove eccellenti proprietà. Negli ultimi anni, il metodo di attivazione di C-H per la post-modifica dei polipeptidi è stato rapidamente sviluppato e sono stati raggiunti molti risultati importanti.
Tempo post: 2025-07-03
