In base al modo di connessione dell'amminoacido e dello zucchero, il peptide dello zucchero può essere suddiviso in quattro categorie: O glicosilazione, glicosilazione C a N, saccarificazione della rugiada e connessione GPI (glicofosfatidlinositolo).
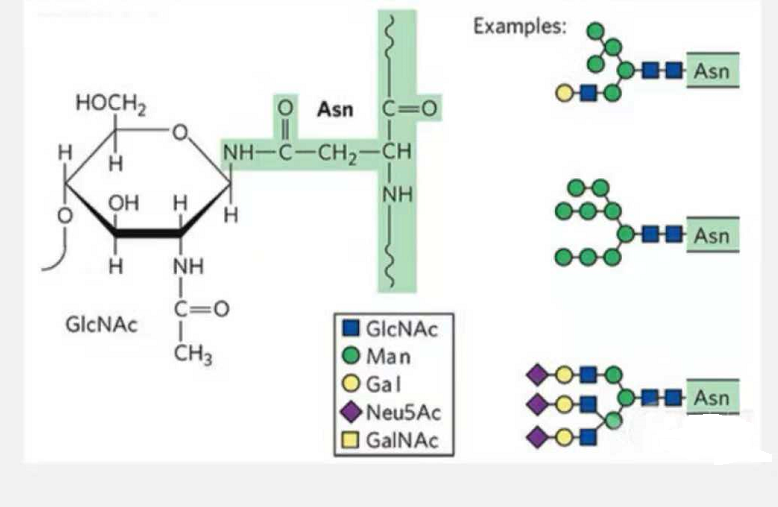
1. I glicopeptidi di N-glicosilazione sono composti da glucosio N-acetammide all'estremità riducente della catena glicanica (Glc-Nac) legato all'atomo di N sul gruppo ammidico della catena laterale di alcuni Asn nella catena peptidica e l'Asn capace di collegare la catena dei glicani deve essere localizzato nell'AsN-X-Ser /Thr (X! =P) nel motivo formato dai residui.Lo zucchero è N-acetilglucosamina.
Glicopeptide strutturale modificato con N-glicosilazione
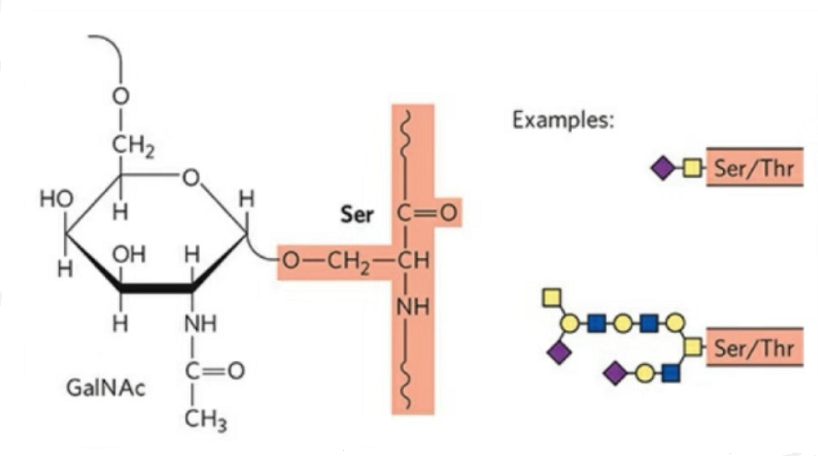
2. La struttura della O-glicosilazione è più semplice della N-glicosilazione.Questo glicopeptide è generalmente più corto del glicano, ma ha più tipi della N-glicosilazione.Ser e Thr possono generalmente essere glicosilati nella catena peptidica.Inoltre, ci sono glicopeptidi decorati con glicosilazione di tirosina, idrossile e idrossiprolina.La posizione del collegamento è l'atomo di ossigeno idrossilico sulla catena laterale del residuo.Gli zuccheri legati sono galattosio o N-acetilgalattosamina (Gal&GalNAc) o glucosio/glucosamina (Glc/GlcNAc), mannosio/mannosamina (Man/ManNAc), ecc.
La O-glicosilazione modifica la struttura
3. Glicosilazione del glicopeptide O-GlcNAC ((N-acetilcisteina (NAC)) (glcnAcN-acetilglucosamina/acetilglucosamina)
Una singola glicosilazione della N-acetilglucosamina (GlcNAc) collega le proteine O-GlcNAc all'atomo di ossigeno idrossilico del residuo di serina o treonina di una proteina.La glicosilazione O-GlcNA è un ornamento monosaccaridico O-GlcNAc senza estensione glicanica;Come la fosforilazione dei peptidi, anche la glicosilazione O-GlcNAc dei glicopeptidi è un processo dinamico di decorazione delle proteine.La decorazione anomala di O-GlcNAc può causare una varietà di malattie come diabete, malattie cardiovascolari, tumori, morbo di Alzheimer e così via.
Punti di glicosilazione dei glicopeptidi
Le strutture di base delle catene di polipeptidi e zuccheri sono collegate alle catene proteiche mediante legami covalenti e i siti che collegano le catene di zuccheri sono chiamati siti di glicosilazione.Poiché non esiste uno stampo per seguire la biosintesi delle catene di zuccheri glicopeptidici, diverse catene di zuccheri saranno attaccate allo stesso sito di glicosilazione, portando alla cosiddetta disomogeneità microscopica.
Glicosilazione dei glicopeptidi
1. Effetto della glicosilazione dei glicopeptidi sull'efficacia terapeutica delle proteine terapeutiche
Nel caso delle proteine terapeutiche, la glicosilazione influenza anche l'emivita e il targeting dei farmaci proteici in vivo
2. Glicosilazione e proteine dei glicopeptidi solubili
Gli studi hanno dimostrato che le catene di zucchero sulla superficie delle proteine possono migliorare la solubilità molecolare delle proteine
3. Glicosilazione dei glicopeptidi e immunogenicità delle proteine
Da un lato, le catene di zucchero sulla superficie delle proteine possono indurre risposte immunitarie specifiche.D’altro canto, le catene di zuccheri possono ricoprire alcune superfici della superficie proteica e ridurne l’immunogenicità
4. Glicosilazione dei glicopeptidi che aumenta la stabilità proteica
La glicosilazione può aumentare la stabilità delle proteine in varie condizioni di denaturazione (come denaturanti, calore, ecc.) ed evitare l'aggregazione delle proteine.Allo stesso tempo, le catene di zuccheri sulla superficie delle proteine possono anche coprire alcuni punti di degradazione proteolitica delle molecole proteiche, aumentando così la resistenza delle proteine alle proteinasi
5. Glicosilazione dei glicopeptidi che influenza l'attività biologica delle molecole proteiche
La modifica della glicosilazione proteica può anche consentire alle molecole proteiche di formare nuove attività biologiche
Orario di pubblicazione: 03 agosto 2023